Ny banebrydende behandling af våd AMD
Ny effektiv behandling af våd AMD kan være en realitet. Med bevillinger fra Dansk Blindesamfunds Øjenfond er professor og øjenforsker Thomas Juhl Corydon rykket et stort skridt nærmere en ny banebrydende behandling af AMD.
AMD er den øjensygdom, der gør flest danskere blinde. Med genterapi er han nu tættere på at udvikle en ny effektiv behandling, der kun skal sprøjtes ind i øjet én gang frem for gentagne, ofte månedlige, injektioner.
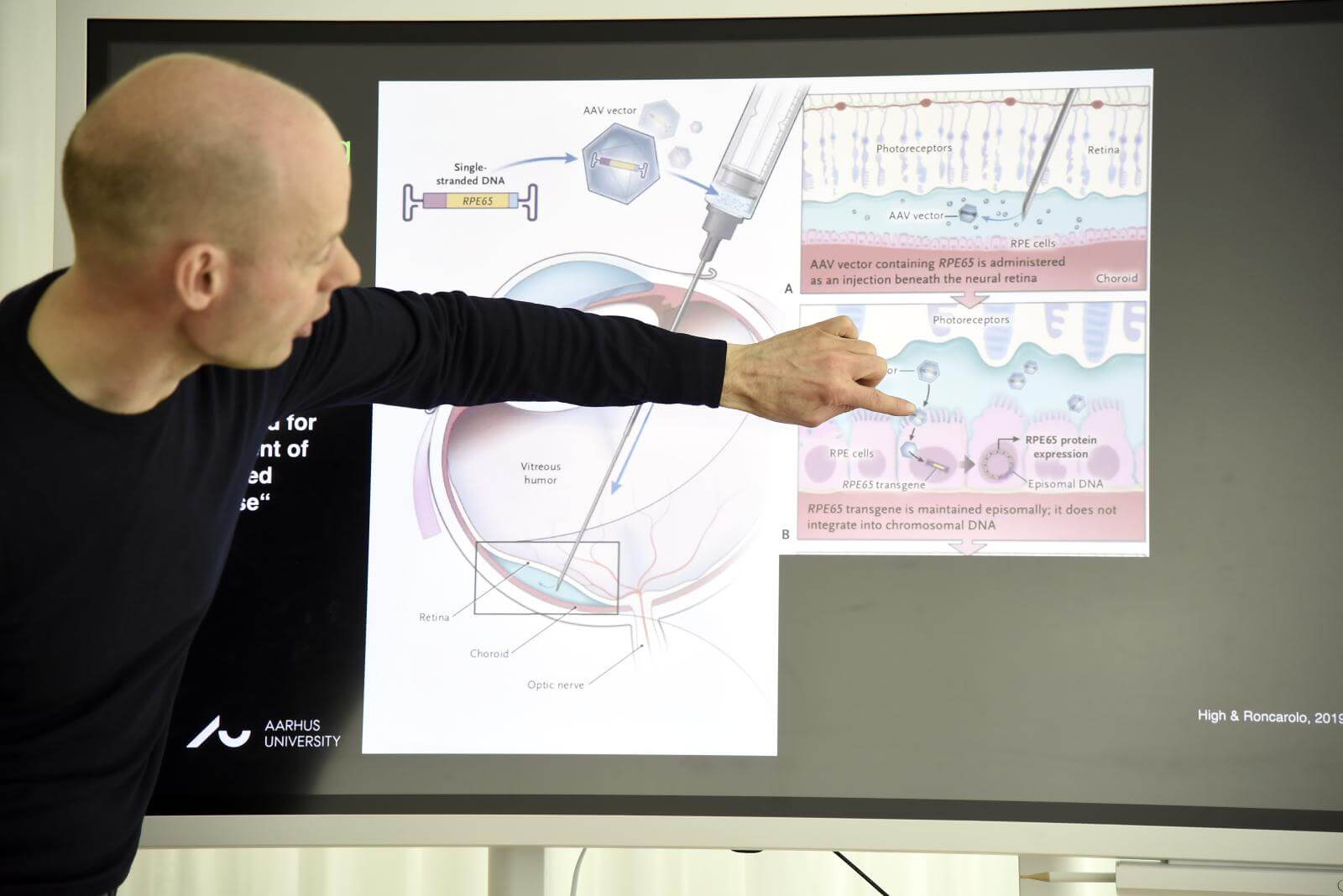
Øjensygdommen AMD (aldersrelateret maculadegeneration) er den hyppigste årsag til blindhed og synstab hos ældre personer i den vestlige verden og betegnes derfor som en folkesygdom blandt ældre.
”Risikoen for AMD stiger markant med alderen, da sygdommen skyldes aldring af øjets nethinde og ophobning af affaldsstoffer – ligesom vores krop bliver slidt med alderen, bliver vores øjne også påvirket af aldringsprocessen”, siger professor og øjenforsker Thomas Corydon ved Institut for Biomedicin, Aarhus Universitet, der i otte år har beskæftiget sig med genterapi i øjet.
Man skelner mellem to former for AMD: den tørre form, hvor ophobede affaldsstoffer med tiden giver tab af nethindens sanseceller og den våde form, hvor der vokser utætte blodkar ind i nethinden, hvorfra der kan sive væske og blod ud i det omgivende væv og medføre nedsat syn. Øjensygdommen forringer gradvist centralsynet, som vi for eksempel bruger til at læse eller genkende ansigter med.
Gentagne indsprøjtninger

”Den våde AMD er den mest aggressive form, men kan i dag behandles ved at sprøjte en væske direkte ind i øjets indre, hvilket hæmmer eller helt stopper væksten af blodkarrene. Man har nemlig fundet ud af, at AMD-patienter har et forhøjet niveau af vækstfaktoren VEGF i nethinden. Behandlingen består derfor af indsprøjtninger med antistoffer mod VEGF, der hæmmer væksten af nye blodkar og udsivning af væske og blod i nethinden”, forklarer Thomas Corydon. Men behandlingen har en begrænset varighed, så derfor skal injektionerne gives hyppigt, cirka en gang om måneden, hvilket belaster både patienterne og sundhedsvæsnet.
”Selv om indsprøjtningerne har vist gode resultater, er det desværre ikke alle patienter med våd AMD, der har gavnlige synseffekter af behandlingen. Vi arbejder derfor intensivt på en behandling til de patienter, der ikke har glæde eller gavn af den nuværende terapi”, fortæller Thomas Corydon, der forsker i en behandling med længerevarende effekt end den, der bruges i dag. Og takket være bevillinger fra blandt andet Dansk Blindesamfunds Øjenfond har Thomas Corydon og hans forskningsteam opnået et gennembrud med genterapi. Det kan i fremtiden betyde, at AMD-patienter optimalt kun skal have én behandling, da genterapien vil kunne holde sygdommen i skak.
Revolutionerende genterapi

Hele ideen med genterapi er, at man får cellerne i øjet til selv at producere den medicin, der skal være med til at holde øjensygdommen i skak i stedet for gentagne indsprøjtninger til gene for patienterne.
”Genterapi betyder i sin enkelthed overførsel af genetisk materiale, DNA eller RNA, til en patient med henblik på sygdomsbehandling. Ved genterapi prøver man enten at tilføre en rask kopi af et gen, der mangler eller er gået i stykker, eller man kan tilføre et gen, som afkoder et molekyle, der for eksempel har til formål at reparere et defekt gen”, forklarer Thomas Corydon. Det er dog vanskeligt at tilføje nøgent DNA i kroppen, men ved hjælp af tæmmede viruspartikler er det muligt effektivt at transportere DNA-sekvenser ind i cellerne. Disse viruspartikler kan kun inficere en enkelt eller nogle få celletyper, der passer til partiklernes overfladeproteiner. Derfor ved forskerne med stor sikkerhed, at det kun er bestemte celler i nethinden, der kan modtage genet og producere et molekyle, som hæmmer VEGF.
Uønsket vækstfaktor
”VEGF er dog lidt speciel, da nethinden også har brug for VEGF, så vi kan ikke fjerne det helt, for så vil nethinden dø. Derfor gælder det om at finde den rette balance, hvor vi udnytter en proces, der hedder RNA-interferens. Her vil særlige RNA-molekyler slukke eller blokere for produktionen af VEGF. Vi ved, at denne proces ikke er hundrede procent, så vi kan ikke få niveauet ned på nul, men derimod ned på 10-20 procent, hvilket spiller godt sammen med, at der skal være lidt tilbage”, siger Thomas Corydon og fortsætter:
”For at undgå den behandlingsresistens, som nogle AMD-patienter oplever ved den nuværende behandling, vil vi ud over at hæmme VEGF også påvirke andre sygdomsprocesser, som er involveret i udviklingen af våd AMD”.
Det er målet at udvikle viruspartikler, som kun skal sprøjtes ind én gang. Foreløbig virker forskningsgruppens viruspartikler på mus i minimum ni måneder. Mus lever dog cirka kun et år, så derfor har det ikke været muligt at registrere data på en længere periode. Næste skridt på forskningsstigen er derfor at afprøve terapien på grise med samme gendefekter.
Fra mus til gris til mennesker
Til det formål har Silja Hansen i år modtaget en bevilling fra Øjenfonden på 190.000 kroner til at udvikle en model, hvor det er muligt at afprøve genterapi i grise, da griseøjne er langt mere sammenlignelige med det menneskelige øje, end museøjne er.

”Griseøjne minder i struktur og størrelse om menneskeøjne. Det vil sige, at hvis vi bruger genterapeutisk medicin, er det nogenlunde den samme dosis, der skal bruges til mennesker. Når jeg opererer eller kontrollerer grise, bruger jeg også maskiner af samme type, som anvendes i øjenklinikken. Derfor er det naturligt at validere de resultater, vi opnåede med forsøgsmusene på grise, før vi tester behandlingen på mennesker”, forklarer Silja Hansen, der er uddannelseslæge i øjenspecialet og ph.d.-studerende på Institut for Biomedicin, Aarhus Universitet og Afdeling for Øjensygdomme, Aarhus Universitets Hospital.
Med grisene tager forskningsteamet altså et vigtigt skridt nærmere klinikken og en eventuel ny patientbehandling. For målet er, at de om fire år står med en behandling, som patienter med våd AMD engang i fremtiden kan få glæde og gavn af.
Når man har fokuseret på forsøg med mus, har man i mange år anvendt laser til at fremprovokere karnydannelsen, da mus ikke bliver gamle nok til at naturligt at udvikle AMD.

Det sker ved at brænde et lille hul i nethinden, som øjet forsøger at reparere ved at danne nye blodkar, hvilket minder om sygdomsprocessen ved våd AMD. Men metoden kan ikke direkte overføres til grise, da laseren ødelægger dele af nethindens ti lag.
”Det betyder, vi får nogle ulemper i sygdomsmodellen, som gør, at den sygdom vi udløser, egentlig er længere væk fra våd AMD hos mennesker. Det medfører også, at det er sværere at aflæse effekten af genterapien, når der er flere ting i spil. Mit fokusområde har derfor været at lave en model, hvor vi undgår at skade nethinden”, siger Silja Hansen, der det seneste år har eksperimenteret med at indsprøjte saltvand i griseøjne for derved at skabe en saltvandsboble, der beskytter øjets lag mod laserens termiske energi.
Sikker og effektiv behandling
”Det har været en lang proces, for der er mange grise, der har været igennem processen, men jeg er glad for, at det er lykkes at skabe en model, hvor det er muligt at udvikle en sygdom med karnydannelse, som ligner det, vi oplever ved AMD-patienter. Det betyder, at vi nu kan teste vores genterapi på grise og dermed er endnu tættere på, at behandlingen kan afprøves på mennesker”, konstaterer Silja Hansen.

”Det er vigtigt, at behandlingen er sikker og effektiv og derfor grundigt undersøgt, inden den kan afprøves på mennesker”, supplerer Thomas Corydon, der er overbevist om, at genterapi får en vigtig betydning for mange andre sygdomme, som man tidligere ikke har kunne behandle medicinsk. Genterapi rettet mod bestemte øjensygdomme har været afgørende for de seneste års fremskridt. Derfor er det også stort for Thomas Corydon og Silja Hansen at bidrage til en forskning, der fremover kan få afgørende betydning for patienter med våd AMD.
”Jeg synes, det er en stor ære at bidrage til øjenforskning, der kan medvirke til fremtidens behandling af våd AMD. Jeg har altid interesseret mig for forskning, der kan få betydning og hjælpe mennesker. For at undgå gentagne injektioner og behandlingsresistens er det vores håb at behandle våd AMD på det tidspunkt og i den del af øjet, hvor sygdommen opstår med én enkelt injektion af gen-bærende vektorer”, siger Thomas Corydon, hvis forskning også bliver fremhævet i anerkendte internationale tidsskrifter.

